Galilei Boltzmann De Broglie Einstein Newton Pauli Radeford Bohr Galerija Kviz
| Galileo Galilei |
| Ludwig Boltzmann |
| Louis de Broglie |
| Albert Einstein |
| Wolfgang Pauli |
| Ernest Raderford |
| Niels Bohr |
| Galerija |
| Kviz |

Ernest Radeford
Ernest Radeford (1871- 1937), bio je britanski hemičar i fizičar.
Nobelovu nagradu za hemiju dobio je 1908. godine. Isprva se bavio
proučavanjem radioaktivnih raspada. Prvi je uočio da se zračenje radija
sastoji od dviju vrsta zraka, koje je nazvao alfa-zrake (α čestica) i
beta-zrake (β čestica) te gama-zračenje (γ čestica). Zajedno sa
Frederickom Soddyem uveo je pojam vremena poluraspada i formulisao
zakone radioaktivnog raspada. Proučavanjem raspršivanja alfa-čestica na
atomima Raderford je došao do zaključka da atom čija je veličina 10-8 cm
nije kompaktan djelić materije, nego složen od pozitivnog jezgra
(veličine 10-12 cm) i elektrona koji kruže oko njega. Raderford je prvi
upotrijebio riječ proton za pozitivno naelektriziranu česticu u jezgru
atoma.
Od njega potiče i formula za raspršivanje alfa-čestica na atomima;
kasnije (1925. godine), Raderford je utvrdio i odstupanje od te formule
do kojeg dolazi kod vrlo bliskih sudara alfa-čestice i jezgra, kad
nuklearno međudjelovanje postaje mnogo važnije od električnog.
Godine 1919. Raderford je, bombardujući azot alfa-česticama izveo prvu
transmutaciju jednog elementa u drugi. Pri procesu je kiseonik, tako je
izvršena prva nuklearna reakcija.
Raderfordov model atoma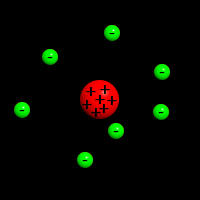
Činjenica koju je utvrdio Raderford, da je alfa-čestica u stvari jon atoma helijuma, da je njena masa 4 puta veća od mase atoma vodonika i da njen električni naboj iznosi dva elementarna električna naboja, omogućila je određivanje električnog naboja svakog atoma. Osim toga, Rutherford je zapazio još jednu važnu pojavu, da se alfa-čestice raspršuju pri prolazu kroz neki materijal, na osnovu koje je zasnovao Rutherfordov model atoma. On je zapazio da se uski snop alfa-čestica, nakon prolaza kroz tanki listić (foliju) metala, skreće od polaznog snopa i da se rasprši. Zapazio je i da se alfa-čestice više rasprše kod prolaza kroz metal, nego kad prolaze kroz zrak.
model atoma
Scintilacija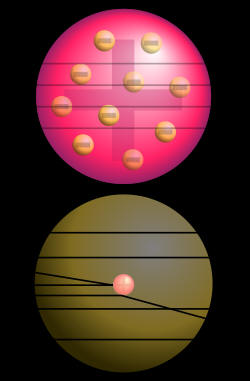
1899. Bekerel (Becquerel) je zapazio još jedno svojstvo radioaktivnog
zračenja i to da izazivaju luminiscenciju kod mnogih hemijskih tvari,
kao što su na primjer cinkov sulfid (ZnS), barijumov platinocijanid
(Ba[Pt(CN)4]x4 H2O) i dijamant. Zapaženo je pomoću mikroskopa da se
luminiscentno svjetlucanje cinkovog sulfida, izazvano alfa-česticama,
sastoji iz velikog broja pojedinačnih bljeskova svjetlosti. Zato što ovo
kratkotrajno svjetlucanje ima sličan izgled svjetlucanju iskri, nazvano
je scintilacija (lat. scintilla znači iskra). Pošto svaka alfa-čestica
svojim udarom o luminiscentni zastor izaziva jednu scintilaciju ili
iskru, Rutherford je predložio da je to vrlo pogodan način za brojanje
radioaktivnih čestica. Na taj način je scintilacija poslužila kao prvi
način za istraživanje količine alfa-čestica.
Rutherford je nastavio oglede, te je koristio je zatvorenu posudu s
pokretnim izvorom alfa čestica koji se mogao staviti na različite
udaljenosti od zastora. Na zastoru su se uz pomoć mikroskopa prikazivale
scintilacije - udarci čestica u zastor koji su izazivali svjetlucanje.
Kad je u posudu stavio kiseonik broj scintilacija se smanjio zbog
apsorpcije alfa čestica u sloju plina. Kad je u uređaj stavio suhi zrak
javio se efekt suprotan očekivanom – broj scintilacija se povećao. Zatim
je posudu napunio čistim azotom i broj scintilacija bio je još i veći.
Na osnovu mnogobrojnih pokusa zaključio je da čestice koje su
prodornije, prelaze veći put i izazivaju scintilacije nastaju zbog
sudara alfa čestica s atomima azota, te da su te nove
čestice atomi vodonika.
prolazak alfa-čestica
Teorija radioaktivnog raspada
Nikako se u to vrijeme nije moglo objasniti odakle tako velika energija
kojom zrače radioaktivne tvari. Na osnovu činjenice da se atomi
radioaktivnih tvari raspadaju i prelaze u atome drugih elemenata
manje težine, tj. da se transmutiraju, Raderford i Frederick Soddy
postavili su 1903. teoriju radioaktivnog raspada. Prema njoj atomi
radioaktivnih elemenata nisu stabilni, nego se spontano raspadaju, uz
zračenje radioaktivnih čestica (alfa-čestica, beta-čestica ili
gama-čestica), pri čemu prelaze u atome drugih elemenata.
Nuklearna reakcija
Teorija radioaktivnog raspadanja je vrlo značajna, jer iz nje proizlazi
da su atomi djeljivi i da mogu prelaziti u atome drugih hemijskih
elemenata. Posto je prelaženje jednog hemijskog elementa moguće samo ako
se promjena događa u atomskom jezgru, možemo zaključiti da je
radioaktivnost u stvari raspadanje jezgra atoma nekih hemijskih
elemenata. Promjena stanja atomske jezgre kod radioaktivnih elemenata se
naziva nuklearna reakcija.






