IIa grupa periodnog sistema elemenata
Zemnoalkalni metali
Zajednička konfiguracija poslednjeg energetskog nivoa im je ns2 gdje je n(2-7).
![]()
+ energija može da pređe u s1p1 konfiguraciju:
![]()
Elektroni se ukrštaju sp hibridizacijom pod 180 stepeni:
![]()
Ovo su laki metali, male gustine, niske vrijednosti za tačke ključanja i topljenja zbog angažovanja samo dva elektrona u metalnoj vezi.
Be odstupa donekle po svojim osobinama. Zemnoalkalni metali provode dobro toplotu i elektricitet. Izvlače se u žice (osim Be), kovni su, energija jonizacije i elektro negativnost imaju niske vrijednosti za ove elemente tako da su oni dobra pedukciona sredstva. Sa oksigenom grade okside:
2M+O2![]() 2MO
2MO
Sa vodom grade hidrokside:
M+2H2O![]() M(OH)2+H2
M(OH)2+H2![]()
Oksidi ovih metala sa vodom daju baze metala:
MO+H2O![]() M(OH)2
M(OH)2
Hidroksida nema u slobodnom stanju a slabo se rastvaraju u vodi. Njihova rastvorljivost se povećava unutar grupe. Zemnoalkalni metali na vazduhu zagrijvanjem na vazduhu grade nitride:
3Mg+N2![]() Mg3N2 - magnezijum-nitrid
Mg3N2 - magnezijum-nitrid
Ovu osobinu ima i alkal litijum:
6Li+N2![]() 2Li3N - litijum-nitrid
2Li3N - litijum-nitrid
Zemnoalkalni metali grade jonska jedinjenja. Karbonati, fosfati i fluoridi su slabije rastvorljivi u vodi od istih soli alkalnih metala. Grade organska metalna jedinjenja. Kalijum i magnezijum su najrasprostrastreniji u obliku jedinjenja. Zemnoalkali boje plamen svjetlosi na sl. način:
Industrijski se dobijeju elektrolizom rastvora njihovih soli:
MgCl2![]() Mg2++2Cl-
Mg2++2Cl-
(-)K: Mg2++2e-![]() Mg
Mg
(+)A: 2Cl--2e-![]() Cl2
Cl2![]()
Ima atomski broj 12.
1s2
2s2 2p6
3s2
Mg2+
Natrijum-hidrogen-fosfat Na2HPO4 u prisustvu amonijalnog pufera je reagens za dokazivanje Mg2+ jona
Mg2++HPO42-+NH3![]() MgNH4PO4
MgNH4PO4
Zato što magnezijum-amonijum-fosfat kristališe u obliku zvjezdica.
Sa kiseonikom magnezijum gradi MgO. Sa hladnom vodom ne reaguje a sa vrekom vodom gradi Mg(OH)2 uz izdvajanje vodonika. U stuji ugljen-dioksida Mg gori uz izdvajanje čađi.
2Mg+CO2![]() MgO+C
MgO+C
Mg je rasprostranjen u obliku:
Magnezijum ulazi u sastav hlorofila:
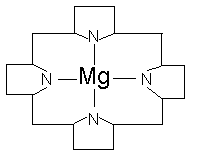
Mg ulazi u sastav morske vode odakle se dobija tako što se svi joni Mg2+ prevode u MgCl2
Magnezijum se dobija elektrolizom rastopa magnezijum-hlorida:
MgCl2![]() Mg2++2Cl-.
Mg2++2Cl-.
(-)K: Mg2++2e-![]() Mg
Mg
(+)A: 2Cl--2e-![]() Cl2
Cl2
Mg gori svijetloblještavim plamenom. Mg je dobro redukciono sredstvo. Ta se osobina koristi za dobijanje nekih drugih metala Ti, Cr
MgCO3![]() MgO+CO2
MgO+CO2![]()
Magnezijum oksid se koristi za proizvodnju vatrostalnih opeka.
MgSO4 - magnezim-sulfat ili gorka so
MgSO4 x H2O i MgSO4 x 7H2O upotrebljavju se u industriji kože, tekstila i medicini.
Ima atomski broj 20.
1s2
2s2 2p6
3s2 3p6
4s2
Kalcijumov jon je pozitivno dvovalentan Ca2+
Reagens za dokazivane Ca2+ jona je amonijum-oksalat (NH4)2C2O4
Ca2++C2O4![]() CaC2O4
- kalcijuum-oksalat je bijela, kristalna supstanca.
CaC2O4
- kalcijuum-oksalat je bijela, kristalna supstanca.
Ca je srebreno bijel, mekan, lagan metal. Zagrijavanjem na vazduhu gradi oksid i nitrid.
2Ca+O2![]() 2CaO
2CaO
3Ca+N2![]() Ca3N2
Ca3N2
Reaguje i sa hladnom vodom gradeci Ca(OH)2 uz izdvajanje vodonika.
Čuva se u petroleumu zbog velike reaktivnosti. u prirodi je veoma rasprostranjen:
Krečnjak - CaCO3
Gips - CaSO4 x 2H2O
Fosforit - Ca3(PO4)2
Fluorit - CaF2
Kalcijum učestvuje u okaštavanju i reguliše zgrušavanje krvi. Soli kalcijuma CaCl2, CaSO4 i magnezijuma MgCl2, MgSO4 čine stalnu tvrdoću vode.
Kalcijum se dobija elektrolizom rastopa kalcijum-hlorida:
CaCl2![]() Ca2++2Cl-
Ca2++2Cl-
(-) K: Ca2++2e-![]() Ca
Ca
(+) A: 2Cl--2e-![]() Cl2
Cl2![]()
Javlja se u dva kristalna oblika kao kalcit i aragonit. Kalicit je u obliku providnih kristala. Krečnjak, mramor i kreda cu kalcitne strukture. Biser je aragonit. Kreda se sastoji od ostataka davno izumrlih biljnih i životinjskih organizama. Krečnjak sa glinom i to laporcem služi za proizvodnju cementa. Krečnjak se slabo rastvara u vodi. međutim, ako voda sadrži CO2 nastaje:
CaCO3+H2O+CO2![]() Ca(HCO3)2
- kalcijum-hidroksikarbonat koji čini prolaznu tvrdoću vode.
Ca(HCO3)2
- kalcijum-hidroksikarbonat koji čini prolaznu tvrdoću vode.
Ta tvdoća se može otkloniti dodavanjem krečne vode:
Ca(OH)2+Ca(HCO3)2![]() 2CaCO3+2H2O
2CaCO3+2H2O
Krečnjak reaguje sa razblaženom hloro-vodoničnom kiselinom:
CaCO3 +2HCl![]() CaCl2+H2O+CO2
CaCl2+H2O+CO2![]()
Žarenjem kerčnjaka na 1100-1300 stepeni celzijusa nastaje živi kreč:
CaCO3![]() CaO+CO2
CaO+CO2![]()
Živi kreč se gasi vodom uz oslobođavanje toplote:
CaO+H2O![]() Ca(OH)2
+ Q
Ca(OH)2
+ Q
Živi kreč je bijel, ako je čist.
CaO+3C![]() CaC2+CO
CaC2+CO
Njegov vodeni rastvor je krečna voda. Suspenzija je krečno mlijeko koje služi za krečenje. Ca(OH)2 u smjesi sa vodom i pjeskom čini malter.
Ca(OH)2 +CO2![]() CaCO3+H2O
CaCO3+H2O
Gips je CaSO4 x 2H2O![]() CaSO4
x 1/2H2O + 3/2H
CaSO4
x 1/2H2O + 3/2H
Vrh Magnezijum Kalcijum Vrati na sadržaj Ia grupa IIIa grupa Kviz
 |
 |
 |
 |
 |
 |