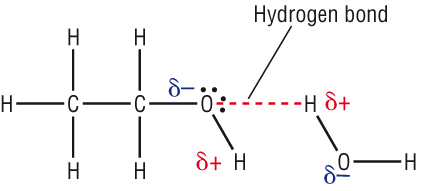
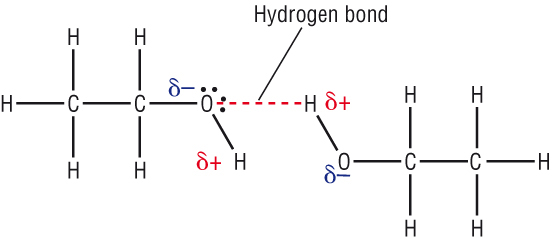
Alkoholi su polarna jedinjenja, po strukturi slični vodi.
Alkoholi sa 1-4 C atoma su tečnosti; 5-10 C uljaste tečnosti; 11C- čvrstog agregatnog stanja.
Temperature ključanja i
topljenja alkohola su više od temperatura
ključanja i topljenja alkana sa odgovarajućim brojem C atoma, kao i alkil-halogenida sa
odgovarajućim brojem C atoma.
Razlog neobično visokih Tklj alkohola je
sposobnost vodoničnog vezivanja. Tklj alkohola rastu sa povećanjem broja C-atoma, a
opadaju sa stepenom razgranatosti lanca.
Rastvoriljivost:
Mnogi alkoholi se dobro rastvaraju u vodi zbog sposobnosti
vodoničnog vezivanja
vode i alkohola:
alkoholi sadrze polarnu O-H vezu tako da je kiseonik -OH grupe parcijalno
negativan (δ-), a vodonik parcijalno pozitivan (δ+).
Kada se parcijalno negativan kiseonik jednog molekula dovoljno približi
parcijalno pozitivnom vodoniku drugog molekula, dolazi do elektrostatičkog
privlačenja, tj. do građenja vodonične veze, usljed čega se molekuli asosuju.
Alkoholi ključaju na višim temperaturama jer je potrebna dodatna energija da
savlada ovo elektrostatičko privlačenje.
Sa povećanjem broja C atoma, smanjuje se
rastvorljivost u vodi, a povećava se
rastvorljivost u nepolarnim rastvaračima (npr., u heksanu).
Rastvorljivost alkohola u vodi se povećava sa povećanjem broja –OH grupa u
molekulu (veća mogućnost vodoničnog vezivanja sa molekulima vode).