PROTEINI
| Trodimenzionalna struktura proteina |
| Osobine proteina |
| Galerija |
| Kviz |
TRODIMENZIONALNA STRUKTURA PROTEINA
Molekuli proteina mogu imati samo jedan polipeptidni lanac. To su monomeri proteini. Proteini su često sastavljeni iz dva ili više polipeptidnih lanaca pa se nazivaju oligomerni.
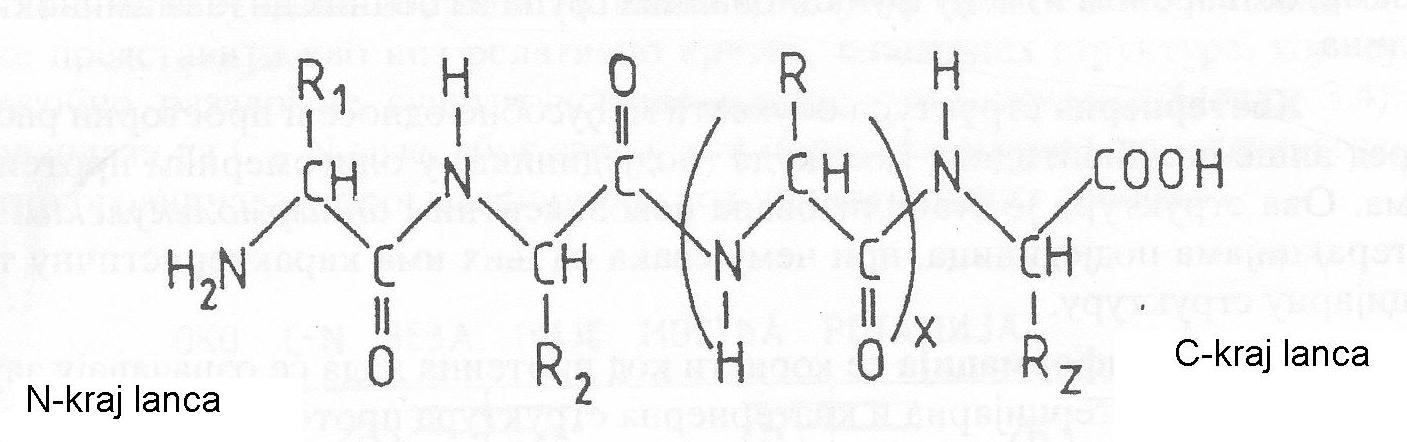
opšta formula strukture polipeptidnog lanca
Različite konformacije su rezultat veoma složenih strukturnih odnosa. Razlikujemo četiri nivoa organizacije u strukturi proteina, to su:
1. primarna
2. sekundarna
3. tercijarna
4. kvaternarna
Naziv konformacija se koristi kod proteina kada se označavaju zajedno sekundarna, tercijarna i kvaternerna struktura proteina.
Detaljnoj konformacionoj analizi složenih molekula proteina su predhodili istorijski radovi nobelovaca Polinga i Korija, koji su na osnovu rezultata dobijenih difrakcijom x-zraka na kristalima aminokiselina i jednostavnih di- i tripeptida utvrdili preciznu geometriju peptidne veze. Činjenica da ce C-N veza peptida kraća u odnosu na istu kod slobodnih aminokiselina oko 40 % navela ih je na zaključak da peptidna veza ima djelimicno dvostruke veze, to sprječava rotaciju u tim dijelovima molekula. Usljed toga četiri atoma peptidne funkcije leže u istoj ravni, pri čemu su kiseonikov atom karbonilne funkcije i H-atom N - H grupe trans-orijentisani.
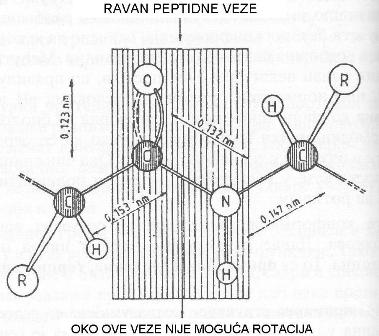
planarna struktura peptidne veze
Ovakva kruta, planarna uređenost je posljedica stabilizacije rezonancom:
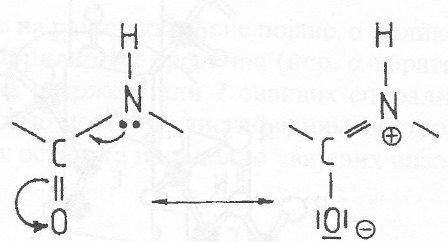
Na osnovu ovih otkrića Polinga i Korija polipeptidni lanac se može predstaviti kao niz relativno krutih, planarnih struktura, koje su međusobno razdvojene supstituisanim metilenskim grupama.
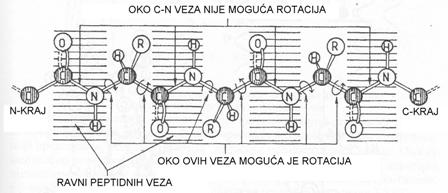
šematski prikaz polipeptidnog lanca
Koristeći precizne modele, Poling i Kori su zatim proučavali mogućnost prostorne orijentacije polipeptidnog lanca u odnosu na jednu centralnu osu, uzimajući u obzir planarnost peptidne veze i njene specifične dimenzije. Pri tome su utvrdili da je najpovoljnije uređenje tzv. α-helikoidalne strukture (heliks-spirala) koja nastaje uvijanjem polipeptidnog lanca oko pokretljivih veza u smjeru kazaljke na satu.
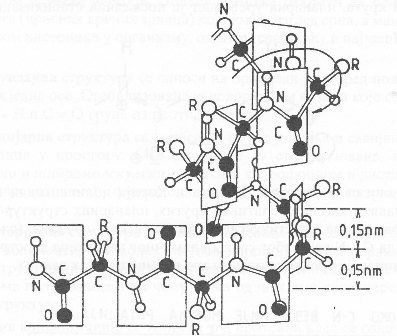
α-helikoidalna struktura polipeptidnog lanca
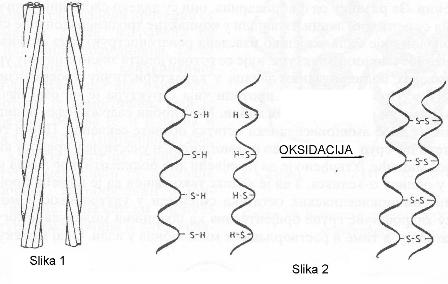
Molekuli α-keratina kose ili vune sadrže 3 ili 7 ovakvih spiralnih struktura (slika 1), koje su međusobno povezane disulfidnim mostovima. Oni nastaju reakcijom cisteinskih ostataka paralelno uvijenih nizova (slika 2).
Neki fibrilarni proteini (npr. fibrion svile) se javljaju u drugoj konformaciji, koja se naziva β-konformacija ili nabrana. Ova konformacija predstavlja "cik-cak" pružanje polipeptidnih lanaca. Oni su međusobno povezani vodoničnim vezama.
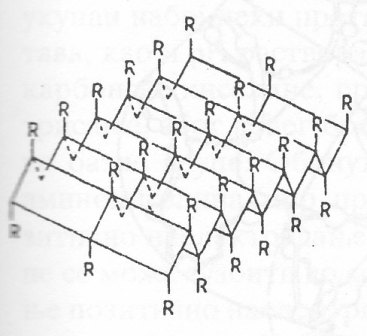
Važna strukturna karakteristika fibrilarnih proteina leži u činjeniici da su bočni nizovi R, kako u α-helikazu, tako i u β-konformaciji, orijentisani prema spoljašnjim dijelovima molekula. S obzirom da u njihovom aminokiselinskom sastavu dominiraju aminokiseline sa hidrofobnim bočnim nizovima, ovi proteini su nerastvorni u vodi, čime je omogućena njihova osnovna uloga - izgradnja zaštitnih i vezivnih tkiva.
Drugu grupu proteina u pogledu konformacije čine tzv. globularni proteini. Za razliku od fibrilarnih, oni su daleko složenije strukture i u njima su peptidni lanci izuvijani u kompaktne trodimenzionalne strukture.
Prvi globularni protein čija struktura je na ovaj način uspješno razjašnjena, bio je mioglobin.
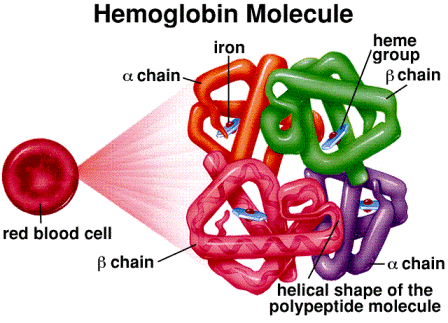
Mnogi globularni proteini su oligomerni, izgrađeni od dvije ili više podjedinica, te se može govoriti o kvaternernoj strukturi. Najpoznatili oligomerni protein je hemoglobin.